近日,华中师范大学绿色农药国家重点实验室杨光富教授团队与中国科学院分子植物科学卓越创新中心凌祺桦研究员团队在国际知名学术期刊Plant Communications(IF 11.6)在线发表题为“Hydroxylation of HPPD facilitates its PUB11-mediated ubiquitination and degradation in response to oxidative stress in Arabidopsis”的研究论文。该研究揭示光合作用关键蛋白HPPD 通过羟基化修饰参与植物的氧化胁迫应答,调控细胞内活性氧稳态,并介导胁迫响应过程,从而提出了植物在光合作用效率与氧化损伤修复平衡中的关键调控模型。

非生物胁迫严重制约植物生长发育,并导致全球农业生产力显著下降。其中,氧化胁迫会诱导活性氧(ROS)过量积累,进而扰乱植物的多种生理过程。对羟基苯丙酮酸双加氧酶(HPPD)在调控植物光合作用及增强氧化胁迫耐受性中发挥关键作用,然而其参与氧化胁迫响应的分子调控机制及其蛋白互作网络仍有待阐明。因此,进一步解析 HPPD 介导的植物抗逆分子机制,已成为当前提升作物抗逆能力的关键科学问题。
本研究利用免疫共沉淀和质谱技术相结合(CO-IP/MS),发现拟南芥HPPD(AtHPPD)会发生苯丙氨酸羟基化修饰,且修饰丰度与应激程度呈正相关。进一步研究表明,羟基化影响AtHPPD正常生物学活性,在体内快速降解(图1)。
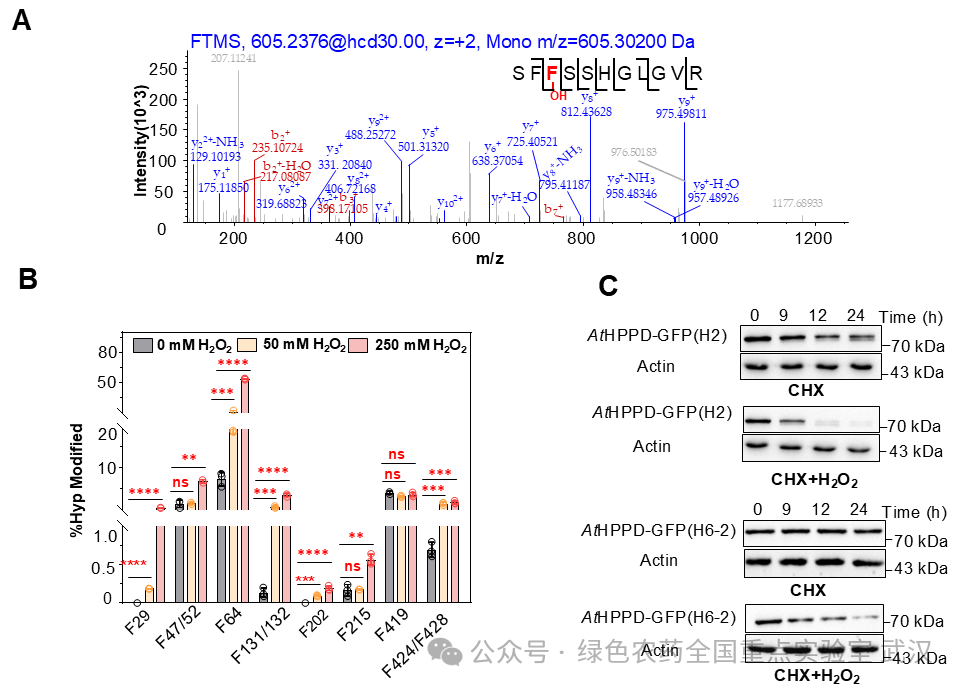
图1 羟基化AtHPPD促进其体内降解
前期研究表明,羟基化修饰可增强底物与 E3 连接酶的相互作用,从而促进底物的泛素化修饰及其降解。本研究进一步解析了AtHPPD 的降解过程:研究团队首先构建了AtHPPD 的蛋白互作网络,并从中筛选出候选 E3 连接酶 PUB11;随后通过酵母双杂交(Y2H)、双分子荧光互补(BiFC)等技术,验证了AtHPPD 与 PUB11 的相互作用,并发现在氧化胁迫条件下,PUB11 与羟基化修饰的AtHPPD 之间的相互作用力会进一步增强(图2)。
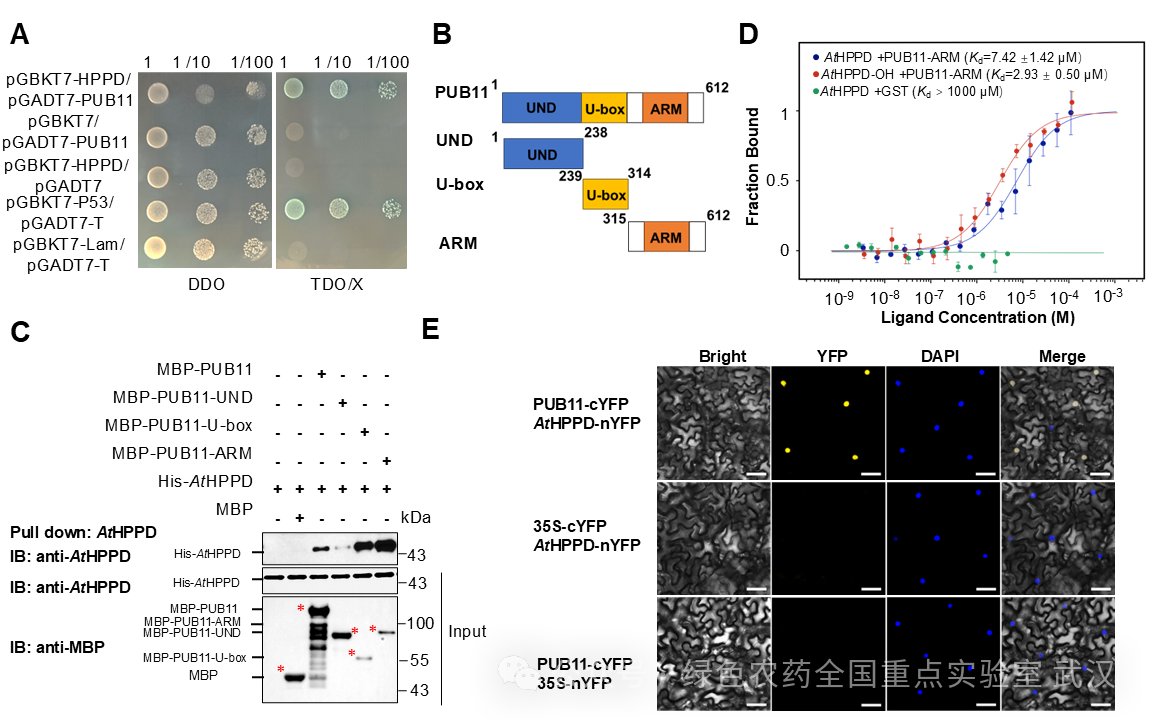
图2 PUB11与AtHPPD具有相互作用
进一步的体内外功能实验结果表明:PUB11 可特异性促进AtHPPD 的泛素化,并通过 26S 蛋白酶体介导其降解,从而加速清除已经失活的AtHPPD。这一降解过程不仅有助于维持AtHPPD 的正常动态周转,还促进了生育酚的积累,最终减轻了氧化胁迫对细胞造成的损伤(图3)。
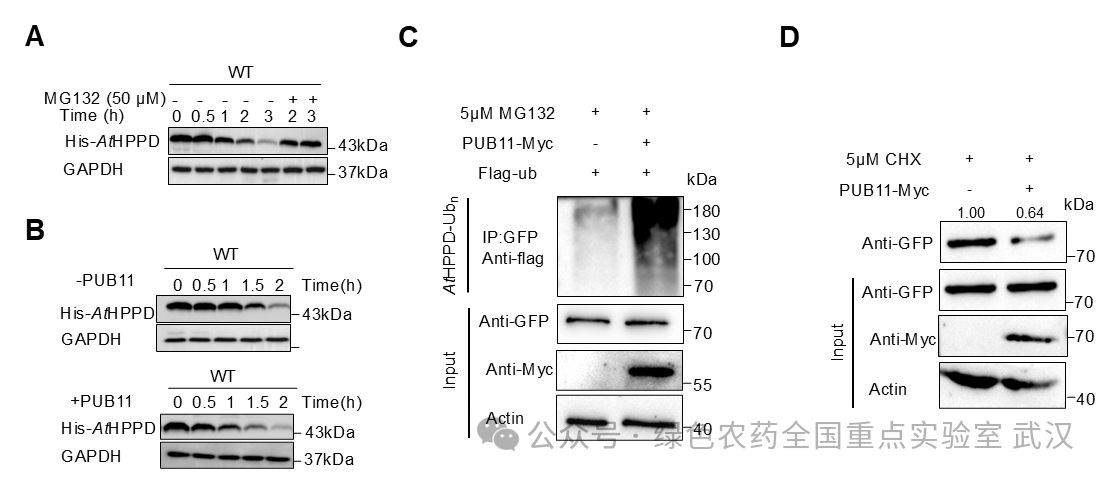
图3 PUB11特异性降解AtHPPD
综上所述,本研究提出了一个以HPPD为核心的新型氧化胁迫响应模型:在植物受到氧化应激时,促进AtHPPD发生羟基化修饰而失活,随后与 PUB11 结合进而通过26S蛋白酶体降解,该过程有助于为新生且具有活性AtHPPD 合成创造条件,帮助植物维持体内活性氧稳态,从而增强对氧化胁迫的适应能力。
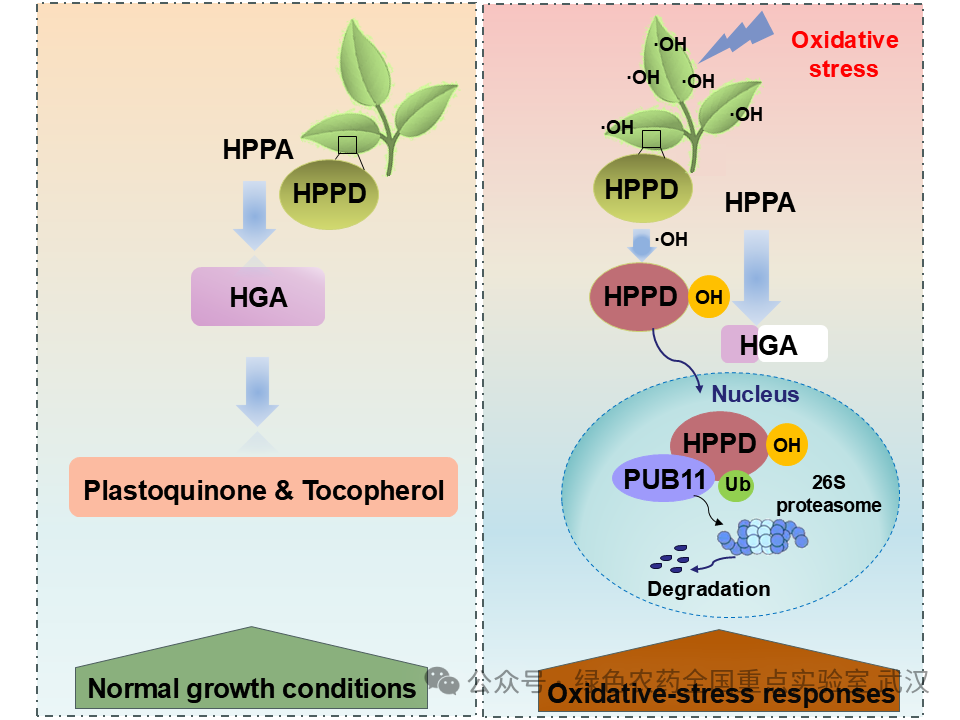
图4 AtHPPD响应氧化胁迫的作用机制
本工作得到了国家自然科学基金面上项目、博士后面上项目、中国科学院战略性前沿基础研究计划等项目的支持。华中师范大学绿色农药全国重点实验室博士后于欣禾、博士生温讯和湖北时珍实验室董江清研究员为本文的共同第一作者。中国科学院分子植物科学卓越创新中心凌祺桦研究员、华中师范大学林红艳副教授、杨光富教授为共同通讯作者。
