来源:《农药》2025(11)
作者:李爱军、安仔涵(河北科技大学化学与制药工程学院) ; 宋鑫源(河北汤武科技有限公司)
苯啶菌酮(pyriofenone)是由日本石原产业株式会社于2001年发现的苯甲酰吡啶类杀菌剂,兼具保护和治疗作用,广泛用于谷物、果树和蔬菜等作物的白粉病防治,卓越的防治效果使其成为白粉病防治领域中用于药剂替代和抗性管理的优选药剂。目前,苯啶菌酮已在韩国、日本、意大利等多个国家登记。2019年全球销售额超600万美元,随着2021年专利保护到期,未来势必表现出良好的市场上升态势。目前国内尚未见该产品的合成工艺研究,也无生产商供应,因此开展其合成工艺研究对推动这一高效杀菌剂的规模化生产具有重要现实意义。
基于苯啶菌酮的分子结构特征,其合成的关键在于酮羰基的构建。根据逆合成分析原理,可从a、b、c这3处切断来构建酮羰基(见图1),由此产生多种合成方法。
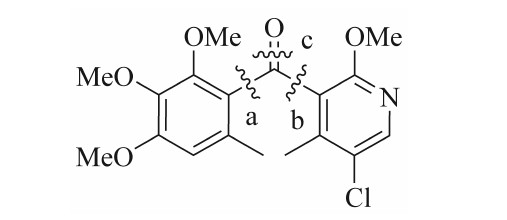
图1 苯啶菌酮的逆合成切断位点示意图
从a和b处切断直接构建羰基,可衍生出4种合成方法(见图2),这4种合成方法涉及吡啶酰氯的傅氏酰基化反应、吡啶羧酸在五氧化二磷存在下的直接酰化反应、苯甲酰氯与格氏试剂在催化剂下的酰化反应以及氯化钯催化下的苯基硼酸酰化反应。在前2个反应中,中间体5-氯-2-甲氧基-4-甲基烟酸的合成需采用昂贵的2-氯-4-甲基烟酸甲酯作为起始原料。且上述4种方法存在共同缺陷,即合成路线最后一步单元反应收率低且成本高。这些缺点使得上述工艺路线不适合作为工业化生产路线。
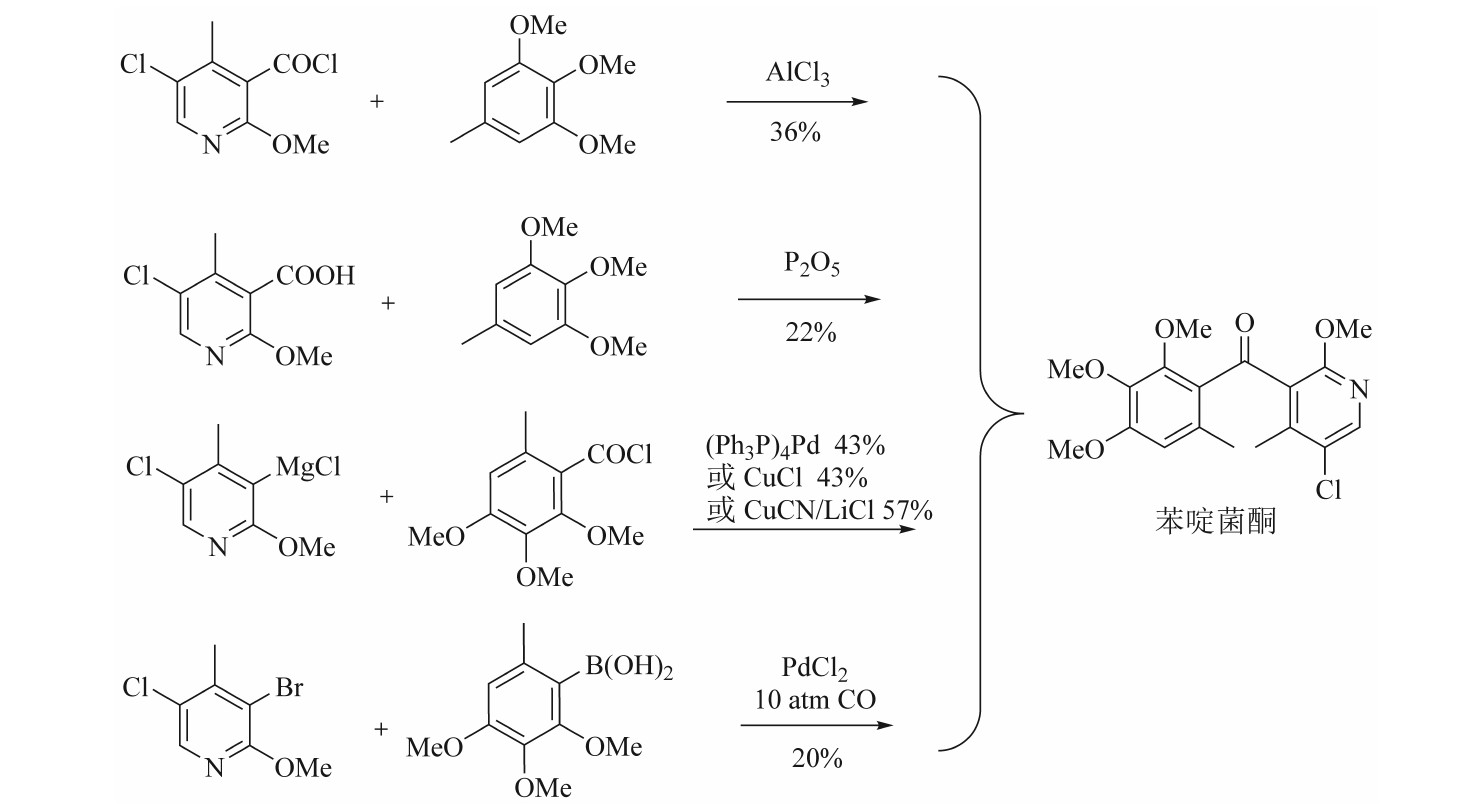
图2 直接构建羰基的苯啶菌酮合成路线
从c处切断涉及到羟基的形成及将羟基氧化为酮羰基的反应(见图3)。3-溴-5-氯-2-甲氧基-4-甲基吡啶经交换反应制得吡啶格氏试剂后,与2,3,4-三甲氧基-6-甲基苯甲醛加成,再经二氧化锰氧化,制得苯啶菌酮。格氏试剂与醛的加成反应收率为70%,氧化反应收率达90%。缺点是活性二氧化锰的用量极大,需达到原料物质的量的20倍以上,该反应为固液非均相反应,在工业化放大时会产生搅拌困难、传质传热不均匀、反应时间长等问题。
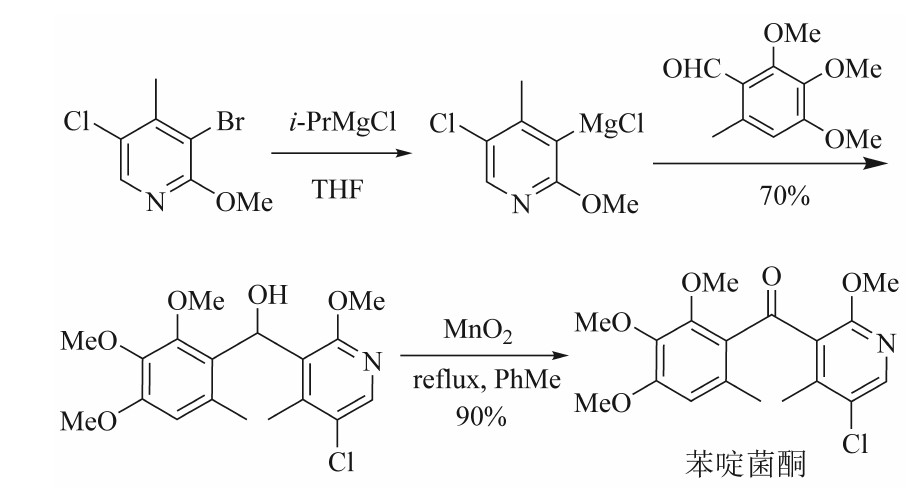
图3 通过羟基构建羰基的苯啶菌酮合成路线
图3中关键中间体3-溴-5-氯-2-甲氧基-4-甲基吡啶的合成路线见图4。2-氨基-4-甲基吡啶在盐酸、甲醇中用亚硝酸甲酯重氮化,得到2-氯-4-甲基吡啶和2-甲氧基-4-甲基吡啶的混合物,2者不用分离,直接进行甲氧基化反应(收率达到95%),进而通过氯化、溴化得到3-溴-5-氯-2-甲氧基-4-甲基吡啶。2-氨基-4-甲基吡啶也可在浓盐酸中通过Sandmeyer反应氯化,但由于重氮盐的水解,会生成杂质2-羟基-4-甲基吡啶,分离之后,2-氯-4-甲基吡啶的收率只有58%。2-氯-4-甲基吡啶的甲氧基化反应收率不等,文献报道分别为46%和75%。甲氧基属于强邻对位定位基团,用NCS氯化时,会生成较多的3位氯化杂质2-甲氧基-3-氯-4-甲基吡啶。该杂质与产物极性非常接近,需要采用柱色谱分离纯化,这显然不适合工业化放大。
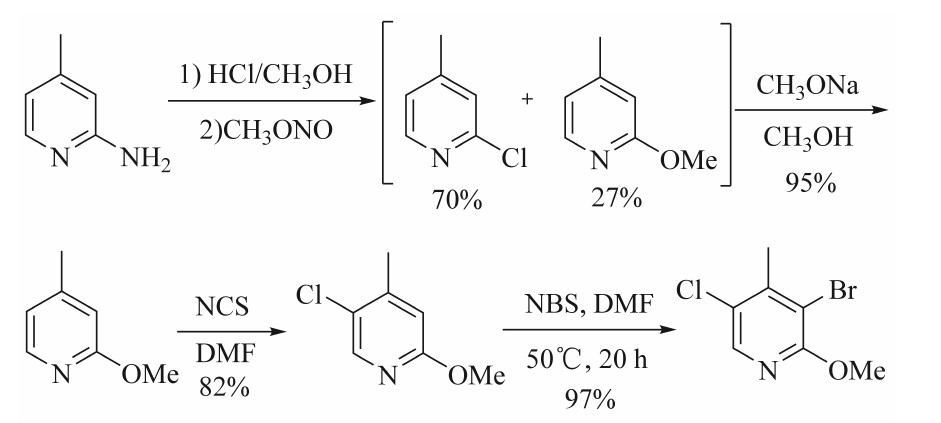
图4 3-溴-5-氯-2-甲氧基-4-甲基吡啶的合成路线
本文借鉴3-溴-5-氯-2-甲氧基-4-甲基吡啶的合成路线,设计了一条以2-氯-3-氨基-4-甲基吡啶为起始原料,合成苯啶菌酮的路线(见图5),并以此为基础进行了合成工艺研究,使之适合不同规模的工业化放大。原料2-氯-3-氨基-4-甲基吡啶为抗病毒药奈韦拉平的关键中间体,市场供应充足,价格合适。原料中的氨基转化为溴原子后,溴原子的占位效应使得氯化反应定位精准,从而避免了柱色谱分离。在氧化反应中,放弃使用传统的二氧化锰氧化法,创新性地采用了DMSO-乙酸酐-三乙胺协同氧化体系,该体系为均相反应体系,传质效率高,反应速度快,避免了二氧化锰法因放大效应导致的搅拌难题及反应停滞风险,为规模化生产提供了更高效的氧化路径。该合成路线具有步骤简短、反应选择性高、产物易分离的特点,具有放大可行性。
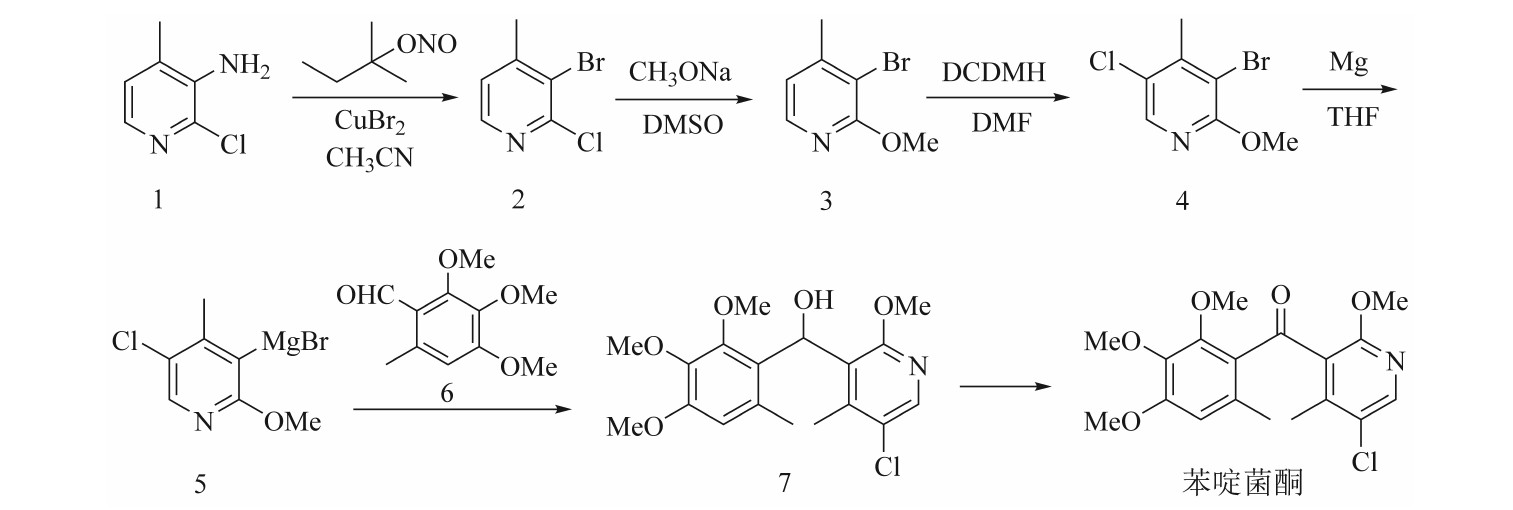
图5 拟定合成路线
1、实验部分
1.1 仪器和试剂
Brucker 400 MHz型核磁共振仪,德国Brucker公司。3-氨基-2-氯-4-甲基吡啶、2,3,4-三甲氧基-6-甲基苯甲醛、亚硝酸叔戊酯、溴化铜、甲醇钠、二氯海因(DCDMH),上海阿拉丁生化科技股份有限公司。溶剂均为市售化学试剂,购自天津市科密欧化学试剂有限公司。
1.2 化合物的合成
1.2.1 3-溴-2-氯-4-甲基吡啶(2)的合成
250 mL三口瓶中加入80 mL乙腈和亚硝酸叔戊酯(0.18 mol,21.1 g),于35~40℃滴加3-氨基-2-氯-4-甲基吡啶(中间体1,0.1 mol,14.3 g)的乙腈(20 mL)溶液,滴毕反应2 h,同温下分5次加入溴化铜(0.11 mol,24.6 g)。加毕,继续反应2 h。加入水50 mL,用10%NaOH(质量分数,下同)溶液调pH 8~9,过滤。滤液用甲基叔丁基醚萃取,静置分层,有机相用无水硫酸镁干燥,过滤,滤液减压浓缩,得黄色固体产物。加入正庚烷打浆,过滤,烘干得到类白色固体16.7 g,收率81%。1H NMR(400 MHz,CDCl3)δ:2.50(s,3H),7.02~7.26(m,1H),8.06~8.34(m,1H)。
1.2.2 3-溴-2-甲氧基-4-甲基吡啶(3)的合成
250 mL三口瓶中加入100 mL DMSO,搅拌下依次加入甲醇钠(0.18 mol,9.7 g)、3-溴-2-氯-4-甲基吡啶(中间体2,0.1 mol,20.6 g),升温至75~80℃反应3 h,然后同温减压蒸馏反应2 h。冷却至室温,加入水、甲基叔丁基醚萃取,静置分层。有机相水洗3次,加入无水硫酸镁干燥,过滤,滤液减压浓缩,得类白色固体产物16.3 g,收率80.5%。1H NMR(400 MHz,CDCl3)δ:2.40(s,3H),4.00(s,3H),6.75(d,J=5.1 Hz,1H),7.92(d,J=5.1 Hz,1H)。
1.2.3 3-溴-5-氯-2-甲氧基-4-甲基吡啶(4)的合成
250 mL三口瓶中加入140 mL DMF、3-溴-2-甲氧基-4-甲基吡啶(中间体3,0.1mol,20.2 g),搅拌溶解。升温至60℃,1 h滴加二氯海因(0.115 mol,22.7 g)的DMF(20 mL)溶液,滴毕,同温继续反应3 h。加入水,用甲基叔丁基醚进行萃取,静置分层,有机相水洗3次,无水硫酸镁干燥,过滤,减压浓缩,得黄色油状物,加入正庚烷,室温搅拌,过滤,得黄色固体产物19.6 g,收率为83%。1H NMR(CDC13,400 MHz)δ:2.51(s,3H),3.98(s,3H),8.01(s,1H)。
1.2.4 (2,3,4-三甲氧基-6-甲基苯基)(5-氯-2-甲氧基-4-甲基-3-吡啶基)甲醇(7)的合成
在氮气保护、25℃下向250 mL三口瓶中依次加入50 mL无水THF、镁屑(0.12 mol,3 g)、1粒碘和3-溴-5-氯-2-甲氧基-4-甲基吡啶(中间体4,0.01 mol,2.3 g)、无水氯化锂(0.04 mol,1.7 g),温度自然上升至55℃,碘色褪去有小气泡生成,引发完成。冷却至10℃,滴加3-溴-5-氯-2-甲氧基-4-甲基吡啶(0.09 mol,21.3 g)与2,3,4-三甲氧基-6-甲基苯甲醛(0.08 mol,16.8 g)的THF(50 mL)的混合液,滴加时间4 h。滴毕同温搅拌1 h。降温至0℃,滴加50 mL10%盐酸溶液,滴毕,室温25℃继续搅拌15 min。反应液静置分层,有机相用饱和氯化钠水溶液洗涤,减压浓缩,得黄色油状物25.2 g,纯度约86%,收率约为86%。杂质不用分离,粗产物直接用于下一步反应。
1.2.5 苯啶菌酮的合成
250 mL三口瓶中加入(2,3,4-三甲氧基-6-甲基苯基)(5-氯-2-甲氧基-4-甲基-3-吡啶基)甲醇(中间体7,0.1 mol,36.7 g)、DMSO(0.3 mol,23.4 g)、三乙胺(0.12 mol,12.1 g),40℃时滴加乙酸酐(0.2 mol,20.6 g),滴加结束后继续反应3 h。反应液加水、甲基叔丁基醚,萃取分层,有机相用20%NaOH溶液洗涤,调pH 7~8,加入无水硫酸镁干燥,过滤,滤液减压浓缩,得黄色固体产物,用甲醇进行结晶,得白色固体28.5 g。收率为78%,纯度98.5%。熔点95℃[文献值(94.5±1)℃]。1H NMR(CDC13,400 MHz)δ:2.30(s,3H),2.40(s,3H),3.30(s,3H),3.71(s,3H),3.74(s,3H),3.87(s,3H),6.54(s,1H),8.06(s,1H)。
2、结果与讨论
2.1 3-溴-2-氯-4-甲基吡啶(2)的合成
Norimine等采用了经典的Sandmeyer溴化反应,分离收率只有59%。实验结果证实此结论,反应过程中生成了较多杂质,原因在于吡啶环的电子密度较低,重氮盐易水解。同时,重氮盐产生的自由基可能发生自身偶联,生成联吡啶类化合物。Doyle等报道了在乙腈中用亚硝酸叔丁酯和溴化铜实现芳胺溴化的方法,避免了重氮盐的水解,因而收率较高。本文以此方法为基础,对3-氨基-2-氯-4-甲基吡啶的溴化进行研究。鉴于亚硝酸叔丁酯的沸点和闪点较低,工业应用时存在静电燃烧的风险。尝试改用亚硝酸正丁酯进行反应,发现重氮盐会与生成的正丁醇反应,生成较多小极性醚类杂质。而亚硝酸叔丁酯产生的叔丁醇亲核性低,生成的醚类杂质较少。受此启发,最终选用沸点和闪点更高的亚硝酸叔戊酯代替亚硝酸叔丁酯,既能减少醚类杂质的生成,又能降低安全风险。
本方法潜在副反应为溴化铜对富电子芳胺的亲电溴化,导致二溴化物杂质生成。为了证实此推测,将3-氨基-2-氯-4-甲基吡啶溶于乙腈,再加入溴化铜升温至60℃反应,结果确有大量溴化物生成。为避免此副反应,采用分步反应策略:先用稍过量的亚硝酸叔戊酯,将氨基转化为重氮盐,再分批加入溴化铜进行自由基溴化。氨基转化为溴原子后,吡啶环的电子密度有所降低,但在高温下仍可能被溴化铜进一步溴化,生成二溴化杂质。因此,取3-氨基-2-氯-4-甲基吡啶(1)与溴化铜的物质的量之比为1∶1.1,并在35~40℃下反应,是避免过度溴化的最佳方式。
反应完毕,直接浓缩回收乙腈再进行后处理,是工业生产中的常规操作,但是该反应由于溴化铜的存在,使得浓缩过程相当于在高温下继续进行自由基溴化反应,导致二溴化物杂质生成。为解决这一问题,在反应结束后,先加入氢氧化钠水溶液对溴化铜进行破坏,可避免后处理过程中过度溴化副反应的发生。浓缩之后的粗产物存在少量小极性杂质,可将其置于正庚烷中,室温下进行打浆,过滤干燥后,得到类白色固体粉末,纯度满足下步氯化反应要求。
2.2 3-溴-2-甲氧基-4-甲基吡啶(3)的合成
此反应为亲核芳香取代反应(SNAr)反应,体系中甲氧基负离子的有效浓度影响取代反应速度及原料的转化率。采用甲醇作溶剂时[9],甲氧基负离子能与甲醇形成氢键从而被甲醇溶剂化,导致甲氧基负离子的有效浓度降低,取代反应速率变慢。实验表明,当3-溴-2-氯-4-甲基吡啶(2)与甲醇钠的物质的量之比为1∶5,并在回流温度下长时间反应时,仍有大量原料未转化,补加甲醇钠该情况也未得到改善。因此,甲醇并非该反应的理想溶剂。采用DMF、DMSO、NMP等极性非质子溶剂,可以促进甲醇钠的解离,并能溶剂化甲醇钠解离出的钠离子,从而提高甲氧基负离子的有效浓度。实验结果表明:采用DMF作溶剂时,在高温和强碱的作用下,DMF会分解产生二甲胺,进而发生二甲胺取代氯原子的副反应。相比之下,DMSO对反应的促进作用最强,生成的杂质较少,因此,选用DMSO作为反应溶剂。
反应过程中生成的甲醇仍可以使DMSO中的甲氧基负离子溶剂化,为使反应基本完全,需将反应温度升至120℃以上,并加入4.5倍的甲醇钠,为此,当反应速度变慢时,可以采取边反应边减压蒸馏的方式,及时将生成的甲醇移出反应体系。这一方法可有效避免甲氧基负离子的溶剂化,不仅能确保反应充分进行,还可减少甲醇钠的用量(见表1)。
表1甲醇钠用量对收率的影响

2.3 3-溴-5-氯-2-甲氧基-4-甲基吡啶(4)的合成
芳环的亲电氯化是芳环上引入氯原子的重要手段。芳环的电子密度越高,氯化反应越易进行。甲氧基的供电性提高了3-溴-2-甲氧基-4-甲基吡啶中甲氧基对位碳原子的电子云密度,使得氯化反应在此位置进行。常用的氯化试剂有二氯海因和NCS,二氯海因的活性要高于NCS,且价格低廉,常用于缺电子芳环的氯化。对于电子云密度中等的3-溴-2-甲氧基-4-甲基吡啶,选用活性更高的二氯海因更为合适,可使反应温度从80℃以上降低至60℃。极性溶剂能够促进二氯海因解离出更多的氯正离子,从而提高氯化反应速度。常用的极性溶剂有硫酸、乙腈、DMF等。前期实验用乙腈作溶剂进行反应时,发现反应速率迟缓且会产生刺激性气味。推测是二氯海因和乙腈发生反应生成氯乙腈所致。因此,放弃选用乙腈作为反应溶剂,改用DMF。
实验过程发现,将所有物料混合后直接升温至60℃反应,在最初的15 min内,反应温度有所上升,这表明氯化反应为放热反应。为避免反应放大时因剧烈放热引起反应温度波动,将加料方式改为滴加二氯海因的DMF溶液,通过控制滴加速度来控制反应速率和反应体系的温度。
理论上,1分子二氯海因能够提供2个氯原子用于氯化反应,实际反应过程可能会有所不同。本文探索了二氯海因用量对反应收率的影响,实验结果见表2。
表2 二氯海因用量对收率的影响

从表2可以看出,随着二氯海因用量的增加,收率增加;当3-溴-2-甲氧基-4-甲基吡啶(3)与二氯海因的物质的量之比为1∶1.15时,收率达到88.4%;继续增加二氯海因的用量,收率增加不显著。为了节约原料,降低成本,取中间体3与二氯海因的物质的量之比为1∶1.15。
2.4 (2,3,4-三甲氧基-6-甲基苯基)(5-氯-2-甲氧基-4-甲基-3-吡啶基)甲醇(7)的合成
格氏反应常用的引发剂有碘、溴乙烷和格氏试剂等。实验表明,溴乙烷在25℃下未引发成功,升温至50℃虽能引发成功,但生成了大量未确定结构的杂质。这说明,3-溴-5-氯-2-甲氧基-4-甲基吡啶(4)在低温下难以形成格氏试剂,在高温下生成的格氏试剂易发生严重的副反应。查阅文献得知,对于较难引发的格氏反应,可在较低的温度下加入一定量的无水氯化锂促进引发,从而在一定程度上抑制格氏试剂自身发生副反应。实验发现(见表3),当3-溴-5-氯-2-甲氧基-4-甲基吡啶(4)与无水氯化锂的物质的量之比为1∶0.4时,室温条件下即可引发反应。
表3 无水氯化锂用量对反应的影响

抑制格氏试剂自身发生副反应是加成反应的关键。研究表明,无论是采用滴加底物醛还是滴加格氏试剂的方式,在较长的滴加过程中,格氏试剂都会因滞留时间长而发生自身偶联副反应。由于醛基具有高亲电活性,其与格氏试剂在低温条件下即可快速发生加成反应,为减少偶联副反应的发生,本实验采用″一步法″进行反应,即格氏反应引发成功后,同时滴加剩余的3-溴-5-氯-2-甲氧基-4-甲基吡啶(4)与2,3,4-三甲氧基-6-甲基苯甲醛(6)的THF溶液,使得格氏试剂一经生成便迅速与中间体6发生加成反应,从而减少副反应的发生。
反应完成之后,采用双水相液液萃取方式分离粗产物,分离操作简单,有利于工业化放大。即用稀盐酸淬灭反应后,加入少量固体氯化钠,搅拌一段时间,静置分层。产物溶解在THF相,用饱和氯化钠水溶液洗涤THF相中溶解的少量水。减压浓缩回收THF,得到油状粗产物,纯度约86%。油状粗产物在本步纯化难度大,直接用于下一步氧化反应,待反应完成后再进行纯化处理。
2.5 苯啶菌酮的合成
苄醇氧化为苄酮的反应中,DMSO氧化法在工业生产中应用广泛。DMSO需经草酰氯、三氟乙酸酐、乙酸酐、DCC等亲电试剂活化形成二甲硫翁离子,加入三乙胺、二异丙基乙基胺等三级胺,可有效促进烷氧基锍盐转换为硫叶立德,进而释放出产物和二甲硫醚。当使用高活性的草酰氯和三氟乙酸酐作为活化剂时,为防止生成的硫叶立德重排为甲硫甲基醚杂质,需在-78℃下进行反应。若以DCC为活化剂,反应可在室温下进行,但生成的脲副产物与氧化产物分离困难,且不适用于大位阻羟基氧化。本文采用乙酸酐和三乙胺进行反应,由于2者体积小、位阻效应低,尤其适用于大位阻二苄醇的氧化。
实验发现,二甲基亚砜用乙酸酐活化后再加二苄醇的加料方式会生成大量杂质,这是由于生成的烷氧基锍盐活性极高,不能与大位阻二苄醇快速反应,导致硫叶立德累积,进而发生重排等副反应造成的。改为先将二苄醇与DMSO混合,再滴加乙酸酐的加料顺序,使二甲硫翁离子生成后立即与二苄醇反应,可显著降低重排副反应和乙酸酐与二苄醇的酯化副反应的发生。
三乙胺能促进烷氧基锍盐脱质子转化为硫叶立德,保障氧化反应顺利进行。实验初期,不加入三乙胺,需将温度升至85℃原料才能转化完全;加入三乙胺后,反应温度可从85℃降至40℃。由于三乙胺用量对反应转化率影响较大,本实验对其用量的影响进行了研究,结果如表4所示。
表4 三乙胺用量对收率的影响

结果表明,三乙胺用量不足,无法充分促进中间体转化,反应不完全,收率低;随着三乙胺用量增加,收率增加;当(2,3,4-三甲氧基-6-甲基苯基)(5-氯-2-甲氧基-4-甲基-3-吡啶基)甲醇(7)与三乙胺物质的量比为1∶1.2时,收率达到80%;继续增加三乙胺用量,收率增加不显著。为降低生产成本,取中间体7与三乙胺的物质的量之比为1∶1.2。
3、结论
以3-氨基-2-氯-4-甲基吡啶为原料,经过重氮化、甲氧基取代、氯代、格氏反应、氧化5个步骤,合成苯啶菌酮,总收率为36.3%,纯度98.5%。此路线避免了难分离副产物的产生,产品纯度高。格氏反应采用″一步法″进行反应,可有效减少副反应的发生;氧化反应创新性的采用DMSO-乙酸酐-三乙胺协同氧化体系代替二氧化锰氧化法,有效克服了后者因搅拌局限导致传质不足、反应时间延长甚至停滞的难题,为规模化生产提供了更高效的氧化路径。

