来源:《世界农药》2026 ,48 (01)
原标题:新型除草剂嘧啶草(噁)唑的合成工艺研究
作者:刘安昌1; 刘家俊1; 敖承四1; 谢睿1; 程子涵1; 余磊2(1.武汉工程大学化工与制药学院 2.武汉软件工程职业学院(武汉开放大学))
Rimisoxafen是富美实公司(FMC)研究开发的兼具嘧啶和异唑结构新型苯联异唑类除草剂,于2021年3月获得ISO通用名,CAS登录号:1801862-02-1,化学名称:3-氯-2-(3-(二氟甲基)异唑-5-基)苯基5-氯嘧啶-2-基醚。化学结构式如图1。
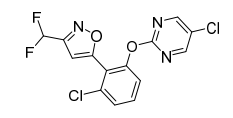
图1 Rimisoxafen化学结构式
rimisoxafen具有新颖双重除草作用机制,不仅可以通过抑制SDPS以损害光合作用,导致植物褪绿并最终死亡实现除草,还可以通过阻断PDS以耗尽类胡萝卜素,导致叶片白化、植物组织发生光氧化破坏实现除草。rimisoxafen可用于玉米、大豆等作物防除杂草,对稗草、黑草、猪殃殃、巨狐尾草、地肤、野苋菜、繁缕、藜、牵牛花、大马塘草、绒毛叶和苋菜藤子等单子叶杂草和阔叶杂草都具有优异防控效果,尤其对抗性苋属植物特别有效,市场前景十分广阔。
rimisoxafen合成路线主要有2条:
路线1:在异丙醇溶剂中,在碳酸钾存在条件下,3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚与2,5-二氯嘧啶缩合得到rimisoxafen,合成路线见图2。
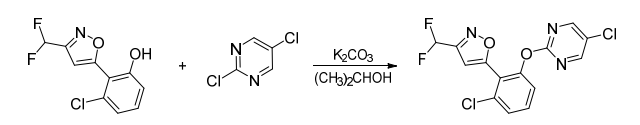
图2 rimisoxafen合成路线1
据文献报道,基于该路线合成rimisoxafen,收率低,难以实现工业化应用。
路线2:在异丙醇溶剂中,在碳酸钾存在条件下,3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚与5-氯-2-(甲基磺酰基)嘧啶缩合得到rimisoxafen,合成路线见图3。
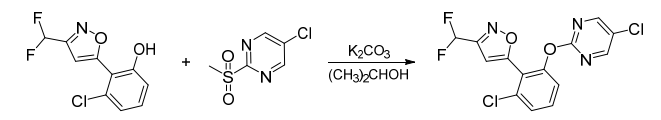
图3 rimisoxafen合成路线2
由于5-氯-2-(甲基磺酰基)嘧啶中的甲基磺酰基是一个很好的离去基团,具有较高的反应活性,基于该路线合成rimisoxafen,其收率高,反应条件温和,适于工业化生产应用。
基于以上反应路线,本文设计了5-氯-2-(甲基磺酰基)嘧啶的合成路线。以氯乙酰氯为原料,在草酰氯的作用下与N,N-二甲基甲酰胺反应,得到2-氯-3-(二甲氨基)-N,N-二甲基丙烯氯化胺,再与S-甲基异硫脲半硫酸盐成环,过氧化氢氧化得到中间体5-氯-2-(甲基磺酰基)嘧啶,合成路线见图4。
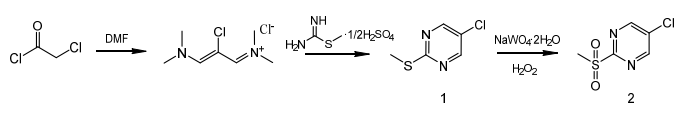
图4 5-氯-2-(甲基磺酰基)嘧啶合成路线
以2,6-二氯苯甲醛为起始原料,经甲基氯化镁格式反应,高锰酸钾氧化生成2',6'-二氯苯乙酮;然后与二氟乙酸乙酯反应得到5-氯-2-(二氟甲基)-4H-苯并吡喃-4-酮,最后和盐酸羟胺环化得到中间体3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚;在异丙醇溶剂中,在碳酸钾存在条件下,3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚与5-氯-2-(甲基磺酰基)嘧啶醚化,合成目标物质rimisoxafen,合成路线见图5。
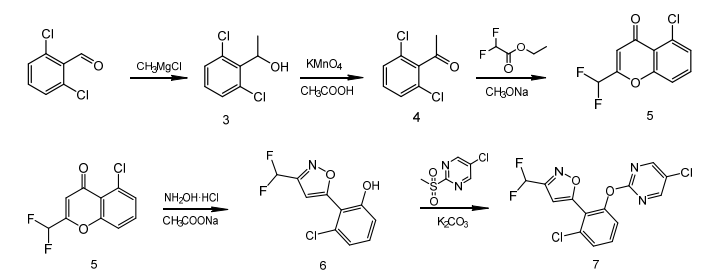
图5 rimisoxafen合成路线
实验部分
1、主要仪器与试剂
400 MR核磁共振波谱仪(安捷伦科技有限公司)、旋转蒸发器、循环水式多用真空泵(科贝科技股份有限公司)。
2,6-二氯苯甲醛(≥98.0%,希恩思化学试剂有限公司),氯乙酰氯(≥98.0%)、S-甲基异硫脲半硫酸盐(≥98.0%,麦克林生化科技有限公司),甲基氯化镁[3.0M THF(四氢呋喃),安耐吉化学试剂有限公司],盐酸羟胺(≥99.0%,武汉格奥恒晟科技发展有限公司),所用溶剂均为工业级。
2、合成方法
5-氯-2-(甲硫基)嘧啶(1)的合成
将N,N-二甲基甲酰胺43.80 g(0.60 mol)加入到250 mL四口反应瓶中,在室温下,滴加氯乙酰氯11.30 g(0.10 mol),滴加完毕后升温至80℃,滴加草酰氯15.24 g(0.12 mol),在75~80℃反应4 h,冷却至25℃,依次加入S-甲基异硫脲半硫酸盐16.68 g(0.12 mol)和无水碳酸钾27.60 g(0.20 mol),升温至70℃反应2 h,反应结束后冷却至40℃,缓慢滴加100 mL水,有大量固体析出。过滤析出的固体,水洗、干燥得到产物9.67 g,收率60.0%。1H NMR(400 MHz,DMSO-d6)δ:8.77 (s,2H),2.56 (s,3H)。
5-氯-2-(甲基磺酰基)嘧啶(2)的合成
将5-氯-2-(甲硫基)-嘧啶16.10 g(0.10 mol)、二水合钨酸钠3.30 g(0.01 mol)以及80 mL乙酸加入到装有搅拌器和回流冷凝管的250 mL四口反应瓶中。加热至60℃,滴加30%双氧水34.00 g(0.30 mol)。滴加完毕,回流反应3 h,反应结束。冷却至室温,加入100 mL水,用150 mL乙酸乙酯萃取。有机层经水洗、干燥、浓缩,用甲苯和庚烷混合重结晶,得到黄色固体16.90 g,收率88.0%。1H NMR (400 MHz,DMSO-d6)δ:9.32 (s,2H),3.47(s,3H)。
1-(2,6-二氯苯基)乙醇(3)的合成
将甲基氯化镁的四氢呋喃溶液42 mL(0.13 mol)加入到250 mL四口反应瓶中,冷却至0℃,滴加2,6-二氯苯甲醛17.50 g(0.10 mol)与100 mL无水四氢呋喃的混合溶液,滴加完毕,继续反应2 h,反应结束。加入饱和氯化铵溶液,用乙酸乙酯萃取。有机相经水洗、干燥、浓缩,得到黄色液体18.10 g,收率95.0%,无需纯化直接用于下一步反应。1H NMR(400 MHz,DMSO-d6)δ:7.47~7.68(m,2H),7.33~7.47(m,1H),5.62(qd,J=6.8,4.3 Hz,1H),4.21(d,J=4.3 Hz,1H),1.47(d,J=6.8 Hz,3H)。
2',6'-二氯苯乙酮(4)的合成
将高锰酸钾19.60 g(0.10 mo1)和60 mL醋酸加入到250 mL四口反应瓶中,室温下,滴加1-(2,6-二氯苯基)乙醇19.10 g(0.10 mol),滴加完毕后,室温继续反应4 h至反应结束,用150 mL乙酸乙酯萃取,有机层经碳酸钠溶液水洗、干燥、浓缩,得到粗产品17.10 g,减压蒸馏5 mm汞柱,90℃出料,得亮黄色溶液15.10 g,收率82.5%。1H NMR (400 MHz,CDCl3)δ7.31~7.27(m,2H),7.25~7.21(m,1H),2.56(s,3H)。
5-氯-2-(二氟甲基)-4H-苯并吡喃-4-酮(5)的合成
将甲醇钠5.94 g(0.11 mo1)和50 mL N,N-二甲基甲酰胺加入到装有搅拌器和回流冷凝管的250 mL四口反应瓶中。室温下,滴加2,6-二氯苯乙酮18.90 g(0.10 mol)和二氟乙酸乙酯14.88 g(0.12 mol)至反应瓶中,滴加完毕,升温至35℃,保温反应1 h。然后加热至150℃,继续反应3 h至反应结束。冷却到室温,加入100 mL水,搅拌、过滤、水洗、干燥,得到固体18.48 g,收率80.0%。1H NMR(400 MHz,DMSO-d6)δ:7.58(t,J=8.2 Hz,1H),7.43(ddd,J=8.3,3.9,1.2 Hz,2H),6.57(d,J=7.0 Hz,1H),6.42 (s,1H)。
3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚(6)的合成
将5-氯-2-(二氟甲基)-4H-苯并吡喃-4-酮23.10 g(0.10 mol)和80 mL乙酸加入到250 mL四口反应瓶中,室温下依次加入盐酸羟胺8.28 g(0.12 mol)和乙酸钠12.30 g(0.15 mol)。室温下搅拌过夜。慢慢滴加20 mL 30%浓盐酸,继续搅拌2 h,加入100 mL水后有大量固体析出。过滤、干燥。得到产物19.20 g,收率78.0%。1H NMR (400 MHz,DMSO-d6)δ:10.69(s,1H),7.37(dd,J=16.7,8.5 Hz,2H),7.08(d,J=1.0 Hz,1H),7.05(d,J=4.7 Hz,1H),7.00(dd,J=8.4,1.0 Hz,1H)。
rimisoxafen(7)的合成
将3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚24.60 g(0.10 mol)、5-氯-2-(甲基磺酰基)嘧啶21.01 g(0.11 mol)、碳酸钾20.70 g(0.15 mol)和60 mL N,N-二甲基甲酰胺依次加入到250 mL的四口反应瓶中。加热至65℃反应2 h,反应结束后加入40 mL水。将反应混合物冷却,用乙酸乙酯萃取,有机相经水洗、干燥、浓缩,得到黄色稠状液,加入正己烷,冷却,析出固体,过滤析出的固体得产物29.21 g,收率81.6%。1H NMR(400 MHz,CDC13)δ:8.45(s,2H),7.57~7.45(m,2H),7.22(dd,J=7.8,1.6 Hz 1H),6.74(s,1H),6.71(s,1H)。
结果与讨论
1、rimisoxafen的核磁共振氢谱( 1H NMR)结构表征确证
对rimisoxafen进行了核磁共振氢谱表征,谱图见图6。
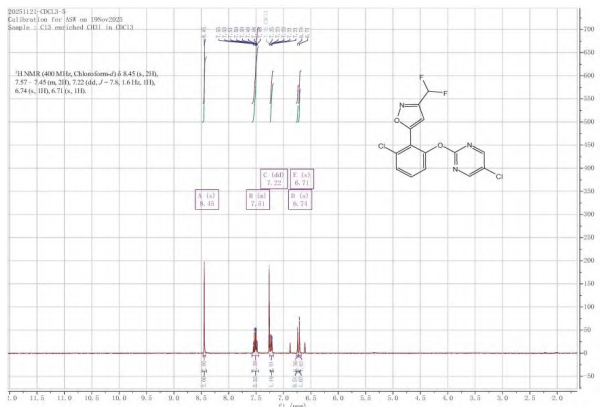
图6 rimisoxafen的1H NMR谱图
从1H NMR(400 MHz,CDCl3)谱图可知:6.71 ppm单峰为异唑-4-氢;6.74 ppm三重峰为二氟甲基(CHF2)氢,该氢受其中F2影响裂分为三重峰;7.22~7.57 ppm多重峰为苯环3个氢;8.45 ppm单峰为嘧啶-4,6-2个氢;7.25 ppm单峰为未氘代溶剂峰。上述谱图表征进一步确证rimisoxafen的结构。
2、5-氯-2-(甲硫基)嘧啶的合成
5-氯-2-(甲硫基)嘧啶的合成过程中,N,N-二甲基甲酰胺先与氯化试剂反应,形成强亲电Vilsmeier中间体,再与S-甲基异硫脲半硫酸盐反应获得5-氯-2-(甲硫基)嘧啶。生成Vilsmeier中间体所需要的氯化试剂种类和用量是影响本反应重要因素。
氯化试剂的选择
反应常用的氯化试剂有二氯亚砜、三氯氧磷、草酰氯等。二氯亚砜与N,N-二甲基甲酰胺反应可以生成Vilsmeier中间体,但中间体过于活泼、不稳定,难以控制;三氯氧磷和N,N-二甲基甲酰胺反应生成Vilsmeier中间体,对温度和加料顺序要求较高,不便操作;草酰氯与N,N-二甲基甲酰胺反应生成Vilsmeier中间体,反应条件温和,便于操作。结合反应条件、反应后处理等因素选择草酰氯作为本反应的氯化试剂。
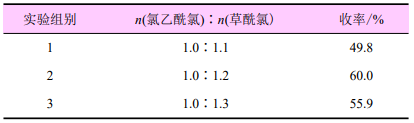
氯化试剂的用量对反应的影响
由表1可知:草酰氯与氯乙酰氯的摩尔比为1.2∶1.0时,收率最高,为60.0%,增加草酰氯的用量,收率基本无变化。故氯化试剂草酰氯与氯乙酰氯的摩尔用量为1.2∶1.0。
表1 草酰氯的用量对反应收率的影响
3、rimisoxafen的合成
在进行醚化过程中,酚羟基在碱的作用下,作为亲核试剂进攻5-氯-2-(甲基磺酰基)嘧啶并且中和离去的甲基磺酰基基团,使反应顺利进行。碱的种类及其使用量对反应有着明显影响。
碱的选择
常用碱有甲醇钠、乙醇钠、三乙胺、氢氧化钠、碳酸盐类等,本文选用了碱性较强的无水碳酸钾,既可以达到实验目的,又降低了成本。故选择碳酸钾作为碱。
碱用量对反应的影响
参考上述rimisoxafen(7)的合成方法,在其他条件不变的情况下,探究了碳酸钾用量对反应的影响,结果见表2。由表2可知:3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚与碳酸钾的摩尔比为1.0∶1.5时,收率最高,为81.6%,增加碳酸钾的用量,收率基本无变化。故碳酸钾与3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚的摩尔用量为1.5∶1.0。
表2 碳酸钾的用量对反应收率的影响

反应时间对rimisoxafen收率的影响
在3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚与碳酸钾的摩尔比为1.0∶1.5,反应温度为65℃的条件下,考察了反应时间对产物收率的影响,结果见表3。
表3 反应时间对反应收率的影响
结果表明:反应2 h即可进行完全。缩短反应时间,反应不彻底;延长反应时间,产率基本无变化。最佳反应时间为2 h。
结论
基于rimisoxafen文献报道合成工艺,以氯乙酰氯为原料,在草酰氯的作用下依次与N,N-二甲基甲酰胺、S-甲基异硫脲半硫酸盐反应成嘧啶环,再氧化得到中间体5-氯-2-(甲基磺酰基)嘧啶;以2,6-二氯苯甲醛为起始原料,经格式反应、氧化反应生成2',6'-二氯苯乙酮,再与二氟乙酸乙酯反应得到5-氯-2-(二氟甲基)-4H-苯并吡喃-4-酮,最后和盐酸羟胺环化得到中间体3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚。在异丙醇溶剂中,在碳酸钾存在条件下,5-氯-2-(甲基磺酰基)嘧啶与3-氯-2-(3-(二氟甲基)异唑-5-基)苯酚醚化合成rimisoxafen。该工艺原料廉价易得,反应条件温和,适于工业化生产。

